1.ORBITAL HIBRIDA dari
NITROGEN DAN OKSIGEN

a. Atom Nitrogen
Semua ikatan kovalen yang dibentuk oleh
unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida.
Secara prinsip, pembentukan hibrida sama dengan pada atom karbon. Amonia, NH3,
salah satu contoh molekul yang mengandung ikatan kovalen yang melibatkan atom
nitrogen. Atom nitrogen memiliki konfigurasi ground-state: 1s2 2s2
2px1 2py1 2pz1, dan memungkinkan atom nitrogen berikatan dengan tiga atom
hidrogen.
Ketika terdapat tiga elektron tak
berpasangan mengisi orbital 2p, ini memungkinkan orbital 1s dari hidrogen untuk
overlap dengan orbital 2p tersebut membentuk ikatan sigma. Sudut ikatan yang
terbentuk adalah 107.30, mendekati sudut tetrahedral (109.50). Nitrogen
memiliki lima elektron pada kulit terluarnya. Pada hibridisasi sp3, satu
orbital sp3 diisi oleh dua elektron dan tiga orbital sp3 diisi masing- masing
satu elektron.
3.orbital oksigen

Hibridisasi yang berikatan dengan
pembentukan ikatan dalam molekul H2O dapat diterangkan menggunakan
orbital hibrida sp3 pada atom oksigen .
Dua orbital ikatan dalam molekul air dapat
dipandang sebagai kombinasi orbital 1s dari hydrogen dengan satu orbital sp3 dari
atom oksigen membentuk dua orbital ikatan σ. Terdapat delapan electron valensi
dalam molekul H2O, enam dari atom oksigen dan dua dari atom
hydrogen. Empat electron valensi menghuni dua orbital ikatan σ dan empat
electron lainnya menghuni dua orbital sp3 yang tidak berikatan.
Sesuai dengan ramalan teori VSEPR bahwa
sudut ikatan H‑O-H dalam molekul H2O lebih kecil dari sudut
tetrahedral murni disebabkan pasangan electron bebas menolak lebih kuat
terhadap pasangan electron ikatan sehingga terjadi distorsi struktur dari
keadaan tetrahedral murni.
2.B.ikatan rangkap terkonjugasi
ikatan rangkap konjugasi adalah ikatan rangkap selang-seling dengan ikatan tunggal atau disebut juga elektronnya dapat berpindah-pindah (terdelokalisasi). Ikatan rangkap keadaan yang terjadi dalam senyawa tak jenuh yang didalam nya terdapat dua ikatan tunggal( satu ikatan sigma dan ikatan pi)menghubungkan dua atom.
Ikatan rangkap terkonjugasi ialah ikatan
yang kedudukan nya di selang oleh satu ikatan tunggal seperti -CH=CH-CH=-CH.
Pengaturan kembali electron melalui orbital π, terutama dalam system konjugasi
atau senyawa organic yang atom-atomnya secara kovalen berikatan tunggal dan
ganda.
Sistem konjugasi terjadi dalam senyawa organik yang atom-atomnya secara
kovalen berikatan tunggal dan ganda secara bergantian (C=C-C=C-C) dan
memengaruhi satu sama lainnya membentuk daerah delokalisasi
elektron. Elektron-elektron pada daerah delokalisasi ini bukanlah
milik salah satu atom, melainkan milik keseluruhan sistem konjugasi ini.
Contohnya, fenol (C6H5OH memiliki
sistem 6 elektron di atas dan di bawah cincin planarnya sekaligus di sekitar
gugus hidroksil.
C.benzena dan resonansi
Senyawa
benzena mempunyai rumus molekul C6H6, dan termasuk dalam
golongan senyawa hidrokarbon aromatik. Nama aromatik digunakan karena senyawa
tersebut berbau harum.dari rumus molekulnya dapat diketahui bahwa benzena
merupakan senyawa tidak jenuh karena tidak memenuhi rumus CnH2n+2.Bila
dibandingkan dengan senyawa hidrokarbon lain yang mengandung 6 buah atom
karbon, misalnya heksana (C6H14) dan sikloheksana (C6H12),
maka dapat diduga bahwa benzena mempunyai derajat ketidakjenuhan yang tinggi.
Dengan dasar dugaan tersebut maka dapat diperkirakan bahwa benzena memiliki
ciri-ciri khas seperti yang dimiliki oleh alkena. Perkiraan tersebut ternyata
jauh berbeda dengan kenyataannya, karena benzena tidak dapat bereaksi seperti
alkena (adisi, oksidasi, dan reduksi).Lebih khusus lagi benzena tidak dapat
bereaksi dengan HBr, dan pereaksi-pereaksi lain yang lazimnya dapat bereaksi dengan
alkena. Sifat-sifat kimia yang diperlihatkan oleh benzena memberi petunjuk
bahwa senyawa tersebut memang tidak segolongan dengan alkena ataupun
sikloalkena.Benzena dengan gugus alkil sebagai substituen, diklasifikasikan
sebagai golongan arena. Penataan nama arena dibagi ke dalam dua golongan
berdasarkan panjang rantai alkil. Jika gugus alkil berukuran kecil (atom C6)
maka gugus alkil diambil sebagai substituen danbenzenasebagai =induknya.

Resonansi ,Metana (CH4) dan etilena (CH2=CH2) adalah contoh dari senyawa organic dengan struktur yang menggunakan garis untuk ikatan pasangan electron). Suatu garis yang menghubungkan dua lambang atom menyatakan ikatan kovalen antara dua atom.
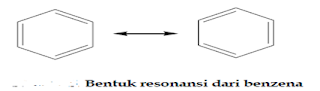
Benzene
adalah contoh suatu senyawa organic yang tidak dapat digambarkan secara pasti oleh
rumus ikatan valensi tunggal.
edua rumus
ikatan valensi untuk benzene ini disebut rumusKekule yang
dicetus oleh Friedrich August kekule pada tahun 1972. Menurut Kekule, kedua
struktur dari benzene bergeser maju mundur dengan cepat, sehingga tidak ada
yang dapat diisolasi secara detail satu per satu.
Kedua
struktur Kekule dikatakan ada dalam resonansi satu
dengan yang lain, alasan inilah yang membuat struktur Kekule disebut sebagai lambangresonansi atau strukturresonansi untuk
benzene.
Struktur
benzene merupakan komposit dari dua struktur resonansi. Jadi, dapat disimpulkan
bahwa benzene adalah hibrida resonansi dari dua
struktur resonansi.
Bila berbagai
struktur resonansi dapat ditulis untuk suatu senyawa, maka dapat dibandingkan
delokasi dari kerapatan electron.














pada pernyataan bahwa Penataan nama arena dibagi ke dalam dua golongan berdasarkan panjang rantai alkil, tolong sebutkan dan jelaskan dua golongan tersebut. terima kasih.
BalasHapusmohon dijelaskan lagi secara konkrit benzena dan resonansi. ?
BalasHapusSaya sedikit menambahkan pada materi resonansi .Resonansi merupakan Penataan electron pada molekul yang terkonjugasi (mengalami delokalisasi electron) sehingga didapat perbedaan wilayah pendistribuat electron. Resonansi terjadi pada senyawa yang memiliki ikatan rangkap terkonjugasi (selang-seling) seperti benzene, 1,3-butandiena, dllMesomeri merupakan pergeseran
BalasHapusUntitled.png kerapatan
electron di sepanjang ikatah phi disebabkan oleh gugus /pasangan penarik dan pendorong electron. Contoh BenzaldehidaDalam struktur yang ditanyakan, gugus fungsi karbonil bukan merukan substituent karena berada pada sistem alakana, jika sistemnya merupakan sistem benzene, maka dia termasuk mesomeri. Namun kenyataanya dia bukan sistem benzene, namun gugus karbonil berada pada sistem alkane jadi dia merupakan resonansi. Perbedaan mesomeri dengan resonanasi terletak pada ada tidaknya substituen yang berikatan pada sistem.
Mengapa ikatan rangkap terkonjugasi dapat disebut elektronnya dapat berpindah-pindah?
BalasHapus